Tecnología Excepcional y Cuidados Extraordinarios a partir de suADN, Genética, Genómica
El origen de la Leucemia infantil:
desentrañando el misterio genómico

Mi Travesía de más de 30 Años: Navegando en las Aguas del Cáncer y la Medicina de Vanguardia
Mi trayecto en la intrincada travesía de comprender el enigma del cáncer y la medicina de precisión se extiende por más de tres décadas. A lo largo de este apasionante periplo, me he adentrado en las profundidades del comportamiento insondable de esta enfermedad. Mi brújula ha sido la Medicina Molecular y la búsqueda constante de nuevas perspectivas, que me ha llevado (junto a otros investigadores) al abordaje del envejecimiento y las dianas terapéuticas como soluciones y como origen de las enfermedades crónicas no transmisibles.

Un Viaje Marcado por la Fascinación
En este viaje, la fascinación ha sido la constante. El cáncer, es un desafío que ha mantenido a la humanidad en vilo durante siglos, se ha convertido en mi compañero de estudio, un enigma que me ha impulsado a buscar respuestas en los rincones más profundos de la biología molecular.

La Medicina de Alta Precisión como Faro
La Medicina de Alta Precisión se ha erigido como un faro en este viaje. Cada avance, cada descubrimiento, ha sido un faro que ha iluminado el camino hacia nuevas posibilidades terapéuticas. La precisión se ha convertido en nuestro aliado en la lucha contra el cáncer y en la búsqueda de estrategias para comprender y controlar el envejecimiento.

Explorando los Componentes del Envejecimiento
En este viaje, hemos navegado por las aguas desconocidas de los componentes del envejecimiento. Cada célula, cada molécula, ha revelado una pieza del rompecabezas que es el proceso de envejecimiento y del cáncer. La ciencia nos ha permitido desentrañar sus secretos y vislumbrar nuevas formas de ralentizar o incluso revertir este proceso.

En Busca de Nuevas Dianas de Tratamiento
La búsqueda constante de nuevas dianas de tratamiento ha sido el motor que ha impulsado este viaje.
Cada descubrimiento nos acerca un paso más a tratamientos más efectivos y personalizados, diseñados específicamente para combatir las diversas facetas del cáncer y del envejecimiento.

En conclusión, un Viaje en Constante Evolución en la que he contado con un cuerpo renovado, al menos, cada diez años. Dicha renovación, se ha convertido en re ingeniería personal y pasión.
A lo largo de estos más de 30 años, mi travesía en el mundo del cáncer y la medicina de precisión ha sido un viaje en constante evolución. Cada experiencia, cada desafío, ha enriquecido mi comprensión de estos campos fascinantes. Y a medida que continuamos avanzando, estoy emocionado por lo que el futuro puede deparar en la búsqueda de respuestas y soluciones que mejoren la vida de quienes enfrentan estas complejas realidades. El día que llegamos a conocer las bacterias, pudimos curar efectivamente las infecciones. Conocer el origen del SIDA nos llevó dos años. Desenmarañar el COVID-19 y desarrollar una vacuna, nos llevó unos meses.
Mientras más conocemos de lo molecular, más cerca estamos de obtener una cura efectiva que corrija o ataque, el problema; apague o encienda las alteraciones Genéticas, o establecer un nuevo patrón Epigenético de tratamiento.
La leucemia infantil, el cáncer más prevalente entre los jóvenes, sigue siendo un tema conmovedor y desconcertante en el ámbito de la ciencia médica. Una intrincada interacción de factores contribuye a sus enigmáticos orígenes. Varias líneas de evidencia sugieren que esta enfermedad amenazante puede comenzar su siniestro viaje durante el inicio mismo de la vida, dentro del útero mismo. En este editorial, nos embarcamos en un viaje exploratorio a través de los anales del origen de la leucemia infantil, a partir del rico tapiz de investigaciones y relatos históricos.

La génesis de la leucemia Infantil
La Dra. María Blasco, remarca el Cáncer y con ellos la Leucemia, como una enfermedad rara, que inicia su perverso crecimiento con las mutaciones intra útero (durante el desarrollo embrionario/fetal, con una posible mutación, además, de la mutación del gen de la Telomerasa.
La leucemia, en su esencia, surge de una anomalía genética fundamental
Se desarrolla cuando ciertas células sanguíneas adquieren mutaciones dentro de su material genético o ADN. Pasando por la falla de múltiples procesos de control y por ello, más común en las personas de mayor edad, a partir de los 40 años, generalmente. Pero en niños el patrón de control se anula y es vencido a partir del desarrollo a muy temprana edad en la Gestación.
El ADN, es el intrincado código que gobierna las funciones celulares, dicta la tasa de crecimiento y la vida útil de una célula, señalando su muerte o apoptosis, para que una nueva surja.
En el caso de la leucemia, este código se distorsiona, causando un crecimiento descontrolado y la evasión de la muerte celular programada o apoptosis.
Sorprendentemente, la leucemia es una enfermedad genética no porque sea hereditaria, sino porque pertenece fundamentalmente al ADN de una persona, el modelo genético de la vida. El ADN, el arquitecto detrás del desarrollo, crecimiento y función celular, juega un papel fundamental en la orquestación del intrincado ballet de la vida dentro del cuerpo humano.

De la oscuridad a la luz:
En los anales de la historia médica, ha habido figuras pioneras que iluminaron el camino para comprender los distintos subtipos de leucemia. Estos subtipos han sido fundamentales en el desarrollo de quimioterapia efectiva, lo que representa un hito fundamental en la investigación de la leucemia durante el último medio siglo.
La primera descripción de casos de leucemia fue presentada por Velpeau en 1827. Once años después, Donné describió a un paciente con exceso de células blancas y, en 1845, un paciente con crecimiento del bazo que murió con material purulento en la sangre fue informado por J.H. Bennett.
En 1856, Rudolf Virchow acuñó el término “leucemia” marcando el comienzo de una búsqueda implacable para comprender y vencer esta devastadora enfermedad. A medida que avanzaba el tiempo, los científicos se lanzaron en una carrera vertiginosa hacia el conocimiento y la esperanza.
Fue Paul Ehrlich quien, con tenacidad inflexible, desarrolló técnicas innovadoras para teñir células, abriendo así una ventana a lo invisible. La leucemia comenzaba a revelar sus secretos en colores vívidos.
Fue Max Neumann quien, con asombroso discernimiento, describió que las células sanguíneas, esas guerreras incansables, nacen en la médula ósea, donde se forja la vida misma.
Pero la revelación más sorprendente llegó de la mano de dos héroes anónimos, David Hungerford y Peter Nowell, quienes en 1960, en un acto de valentía científica, revelaron el cromosoma Filadelfia en pacientes con leucemia mieloide crónica. Una pieza crucial del rompecabezas había sido encontrada.
En el sombrío horizonte de 1947, el patólogo Sidney Farber se convirtió en un faro de esperanza. A través del bioquímico Yellapragada Subbarow, Farber obtuvo antagonistas del ácido fólico y los administró a niños con leucemia. Fue así como el mundo atestiguó las primeras señales de remisión temporal, un atisbo de la victoria
por venir.
Hoy, en un mundo que avanza sin cesar hacia el futuro, el progreso científico ha dado paso a un fenómeno asombroso: la terapia dirigida. El imatinib, por ejemplo, ha brillado como una estrella guía en el tratamiento de ciertas formas de leucemia. La llamada “terapia de dianas” ofrece esperanza renovada a pacientes con diversos cánceres, una luz en la oscuridad de la enfermedad.
Una ruta de soluciones
Cada avance científico, cada nombre grabado en la historia, nos recuerda que la lucha contra la leucemia es una batalla que libramos juntos, una búsqueda incansable de respuestas, y una promesa de un mañana mejor para aquellos que enfrentan este desafío. En cada paso que damos, honramos a aquellos pioneros que allanaron el camino hacia la esperanza.

¿Cómo se clasifican las leucemias según la OMS?
La clasificación de la OMS se basa en una combinación de características clínicas, morfológicas, inmunofenotípicas y genéticas.
Otros sistemas de clasificación menos utilizados incluyen el sistema French-American-British (FAB), que se basa en la morfología de los leucocitos anormales.
Epidemiología de la leucemia infantil
La leucemia infantil emerge como el cáncer más prevalente en niños y adolescentes, constituyendo casi un tercio de todos los cánceres pediátricos. No obstante, en el contexto más amplio, la leucemia infantil sigue siendo una enfermedad rara. Se manifiesta predominantemente como leucemia linfocítica aguda (LLA) en aproximadamente el 75% de los casos, con leucemia mieloide aguda (LMA) que comprende la mayoría de los casos restantes.
Factores de alto riesgo
Ciertos factores elevan el riesgo de desarrollar leucemia. La edad es un determinante clave, y las personas mayores de 65 años son más susceptibles. Demográficamente, los hombres blancos enfrentan un mayor riesgo. Además, la exposición a la radiación ionizante, como la de las detonaciones de la bomba atómica, aumenta la probabilidad de desarrollo de leucemia.
El amanecer de una nueva era
El punto de inflexión en la historia de la leucemia infantil llegó en 1970 cuando el Dr. Donald Pinkel del St. Jude Children's Research Hospital declaró que la leucemia infantil ya no era una enfermedad incurable. Con una tasa de curación del 50% Malcanzada, el panorama del tratamiento de la leucemia experimentó una profunda transformación.
Genética y cánceres infantiles

Aproximadamente el 5% de los cánceres infantiles provienen de mutaciones heredadas transmitidas de padres a hijos. La mayoría de los cánceres infantiles, al igual que sus contrapartes adultas, son el resultado de mutaciones en genes que estimulan el crecimiento celular descontrolado. La mutación del gen de la telomerasa es un ejemplo de ello, que ejemplifica la intrincada red genética en la formación del
cáncer.
Cánceres hereditarios
El cáncer se puede heredar a través de una mutación genética presente en el óvulo o el espermatozoide durante la fertilización. Estas mutaciones están implicadas en varios cánceres comunes y menos comunes, como el cáncer de mama, colon, próstata, páncreas y ovario.

Dos tipos de cánceres en un mismo paciente
Aunque es raro, no es sin precedentes que las personas luchen contra dos cánceres primarios distintos simultáneamente.
La investigación sugiere que aproximadamente 1 de cada 20 personas diagnosticadas con cáncer lidian con este desafío único.
El origen de la leucemia infantil, una enfermedad que infunde miedo en los corazones de las familias de todo el mundo, sigue siendo una intrincada red de genética, relatos históricos e investigaciones pioneras. Es un recordatorio conmovedor de los avances que hemos logrado y las complejidades que seguimos desentrañando en nuestra búsqueda para conquistar a este formidable adversario.
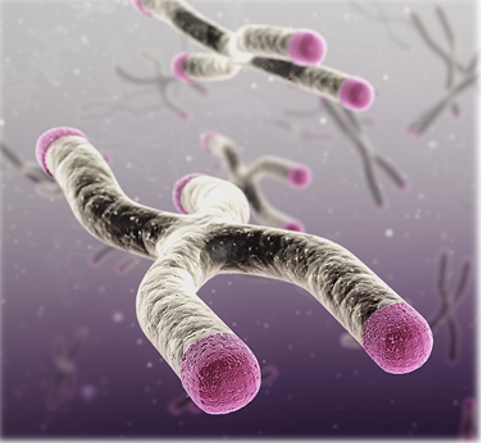
La Telomerasa y el Cáncer
La Telomerasa:
Un Enigma en la Lucha contra el Cáncer
Me dedico en este tramo de la narrativa de mi humilde y breve acervo, para indicar que en el intrincado rompecabezas de la biología y la oncología, la telomerasa emerge como una figura enigmática que plantea interrogantes tanto esperanzadoras como ominosas.
Desde los avances en la Medicina Molecular y la Epigenética hasta la precisión de la Medicina de Alta Precisión, la investigación científica ha arrojado luz sobre los vínculos entre la telomerasa y el cáncer, especialmente en el contexto de la leucemia infantil.
Para mí (Conrado Rivera) el arte impresionante y apasionado de mi encuentro con el cáncer y sus capacidades.
Así que no voy a dejar esta publicación sin mencionar los misterios que rodean a esta enzima, que, si bien se considera una diana terapéutica prometedora en la lucha contra el envejecimiento, también desempeña un papel en el crecimiento y la propagación de las células cancerosas.
Telomerasa:
Entre la Juventud y la Malignidad
La telomerasa, esa enzima encargada de alargar los telómeros, los guardianes de la estabilidad genómica, ha sido objeto de atención creciente en el ámbito de la medicina y la biología molecular. Su capacidad para prolongar el período de “juventud” celular, libre de enfermedades crónicas catastróficas, ha avivado las esperanzas de tratamientos que puedan retrasar el envejecimiento y mejorar la calidad de vida. Sin embargo, esta misma enzima también despierta inquietantes cuestionamientos.
La Dualidad de la Telomerasa
La telomerasa es como un arma de doble filo en la batalla contra el cáncer. Por un lado, podría ofrecer una vía para frenar el crecimiento de células malignas al extender los telómeros, limitando así su capacidad de división y replicación.
Por otro lado, es una aliada involuntaria de las células cancerosas, ya que algunas de ellas desarrollan una telomerasa mutada que les permite crecer de manera más eficiente, convertirse en tumores malignos y propagarse mediante sus metástasis.
El Conflicto Desentrañado
La pregunta fundamental que surge es si existe un conflicto insalvable entre la telomerasa como objetivo terapéutico en la lucha contra el envejecimiento y su papel en el cáncer. Los estudios específicos arrojan luz sobre este enigma.
Se ha descubierto que las células cancerosas carecen inicialmente de su propia telomerasa, pero, mediante una astuta coreografía de mutaciones y adaptación celular, crean su propia versión de esta enzima, diseñada exclusivamente para satisfacer sus necesidades. Esta telomerasa mutada otorga inmortalidad a las células malignas, permitiéndoles una proliferación acelerada.
La Esperanza Reside en la Precisión
Sin embargo, el conflicto se resuelve de manera esclarecedora en el laboratorio. Al instilar telomerasa en células sanas in vitro, se ha logrado que estas células adquieran inmortalidad sin mutar hacia la malignidad. Este descubrimiento abre la puerta a posibles terapias que aprovechen la telomerasa para mejorar la salud y la longevidad sin los peligros asociados al cáncer.
De la Duda a la Promesa de la Curación:
La Danza del ADN del Cáncer
Las investigaciones en curso abren ante nosotros un desafío monumental y emocionante. Nos enfrentamos al intricado laberinto de la información genética que constituye el ADN del cáncer, una entidad que se distingue de la del ADN de su portador. En este viaje de descubrimiento, vamos desentrañando los misteriosos puntos de partida desde donde el ARN del cáncer inicia su danza de mutaciones, que culmina con la producción de la telomerasa maligna mutada dentro del propio cáncer.

En esta búsqueda incansable, nuestro objetivo es claro: crear un medicamento capaz de interceptar esta danza genética específica, bloqueando la telomerasa del cáncer en su origen. Imaginemos, por un momento, el fruto de este esfuerzo gitanesco: lo que yo en décadas he descrito como un “pacto interesante” entre el cáncer y el paciente.
En este acuerdo, ambas partes coexisten en el mismo escenario, pero con una diferencia fundamental: el cáncer no puede dar rienda suelta a su desenfrenado crecimiento tumoral, y el paciente no se convierte en víctima de una enfermedad despiadada. Esta visión, forjada a lo largo de décadas de investigación, nos ofrece la esperanza de un mañana donde el cáncer sea una fuerza controlada, una enfermedad que no determine el destino de aquellos que la padecen.
La luz brilla con intensidad
En este incansable viaje, avanzamos de la duda inicial hacia la promesa de la curación, siguiendo los pasos del ARN del cáncer en su compleja coreografía genética. La ciencia nos muestra que, incluso en los rincones más oscuros de la enfermedad, la luz de la esperanza brilla con intensidad.
Una Revelación en el Laboratorio:
El Poder Transformador de la Telomerasa en Células Sanas
La maraña de interrogantes empieza a deshilacharse en el escenario del laboratorio, donde la ciencia nos brinda una revelación impactante. Es en este espacio de descubrimiento que arrojamos luz sobre un enigma que ha desconcertado a la comunidad científica. Aquí, en este crisol de conocimiento, encontramos la clave para resolver el enigma de la telomerasa y su relación con las células sanas.

La telomerasa, esa enzima capaz de alargar los telómeros y otorgar inmortalidad, a las células se convierte en una protagonista en este emocionante capítulo.
Cuando se introduce telomerasa en células sanas in vitro, ocurre una metamorfosis asombrosa. Estas células, en lugar de someterse a la mutación que a menudo conduce a la malignidad, se transforman en entidades inmortales, conservando su integridad genética original y sana.
La Telomerasa del Cáncer es su propia Telomerasa Mutada
Este descubrimiento no solo aclara la confusión que rodea a la telomerasa, sino que también arroja un rayo de esperanza en la batalla contra el envejecimiento y las enfermedades relacionadas. En el laboratorio, presenciamos cómo la telomerasa puede extender la vida de las células de manera espectacular, sin los peligros inherentes a la transformación maligna.
En esta narrativa científica, el laboratorio se convierte en el escenario de un renacimiento, donde las células sanas encuentran un camino hacia la inmortalidad sin sucumbir a las amenazas de la malignidad. Es un testimonio de la intrincada danza de la biología y la promesa de la ciencia, donde cada experimento nos acerca un paso más a comprender los secretos de la telomerasa, su potencial revolucionario y el ancestral dilema del envejecimiento, la edad y la Longevidad..

Bibliografía
1. Andersson A. K., Ma J., Wang J., Chen X., Gedman A. L., Dang J., et al.
(2015). The landscape of somatic mutations in infant MLL-rearranged acute
lymphoblastic leukemias. Nat. Genet. 47 330–337. 10.1038/ng.3230 [PMC free
article] [PubMed] [CrossRef] [Google Scholar]
2. Azzoni E., Conti V., Campana L., Dellavalle A., Adams R. H., Cossu G., et al.
(2014). Hemogenic endothelium generates mesoangioblasts that contribute to
several mesodermal lineages in vivo. Development 141 1821–1834.
10.1242/dev.103242 [PubMed] [CrossRef] [Google Scholar]
3. Azzoni E., Frontera V., McGrath K. E., Harman J., Carrelha J., Nerlov C., et al.
(2018). Kit ligand has a critical role in mouse yolk sac and
aorta–gonad–mesonephros hematopoiesis. EMBO Rep. 19:e45477.
10.15252/embr.201745477 [PMC free article] [PubMed] [CrossRef] [Google
Scholar]
4. Balgobind B. V., Zwaan C. M., Pieters R., Van Den Heuvel-Eibrink M. M. (2011).
The heterogeneity of pediatric MLL-rearranged acute myeloid leukemia.
Leukemia 25 1239–1248. 10.1038/leu.2011.90 [PubMed] [CrossRef] [Google
Scholar]
5. Barrett N. A., Malouf C., Kapeni C., Bacon W. A., Giotopoulos G., Jacobsen S.
E. W., et al. (2016). Mll-AF4 confers enhanced self-renewal and lymphoid
potential during a restricted window in development. Cell Rep. 16 1039–1054.
10.1016/j.celrep.2016.06.046 [PMC free article] [PubMed] [CrossRef] [Google
Scholar]
6. Benz C., Copley M. R., Kent D. G., Wohrer S., Cortes A., Aghaeepour N., et al.
(2012). Hematopoietic stem cell subtypes expand differentially during
development and display distinct lymphopoietic programs. Cell Stem Cell 10
273–283. 10.1016/j.stem.2012.02.007 [PubMed] [CrossRef] [Google Scholar]
7. Bernard O. A., Romana S. P., Poirel H., Berger R. (1996). Molecular
cytogenetics of t(12;21)(p13;q22). Leuk. Lymphoma 23 459–465.
10.3109/10428199609054854 [PubMed] [CrossRef] [Google Scholar]
8. Bertrand J. Y., Chi N. C., Santoso B., Teng S., Stainier D. Y. R., Traver D.
(2010). Haematopoietic stem cells derive directly from aortic endothelium during
development. Nature 464 108–111. 10.1038/nature08738 [PMC free article]
[PubMed] [CrossRef] [Google Scholar]
9. Bian Z., Gong Y., Huang T., Lee C. Z. W., Bian L., Bai Z., et al. (2020).
Deciphering human macrophage development at single-cell resolution. Nature
582 571–576. 10.1038/s41586-020-2316-7 [PubMed] [CrossRef] [Google
Scholar]
10. Böiers C., Carrelha J., Lutteropp M., Luc S., Green J. C. A., Azzoni E., et al.
(2013). Lymphomyeloid contribution of an immune-restricted progenitor
emerging prior to definitive hematopoietic stem cells. Cell Stem Cell 13
535–548. 10.1016/j.stem.2013.08.012 [PubMed] [CrossRef] [Google Scholar]
11. Böiers C., Richardson S. E., Laycock E., Zriwil A., Turati V. A., Brown J., et al.
(2018). A Human IPS model implicates embryonic B-myeloid fate restriction as
developmental susceptibility to B acute lymphoblastic leukemia-associated
ETV6-RUNX1. Dev. Cell 44 362. 10.1016/j.devcel.2017.12.005 [PMC free
article] [PubMed] [CrossRef] [Google Scholar]
12. Boisset J. C., Van Cappellen W., Andrieu-Soler C., Galjart N., Dzierzak E.,
Robin C. (2010). In vivo imaging of haematopoietic cells emerging from the
mouse aortic endothelium. Nature 464 116–120. 10.1038/nature08764
[PubMed] [CrossRef] [Google Scholar]
13. Bolouri H., Farrar J. E., Triche T., Ries R. E., Lim E. L., Alonzo T. A., et al.
(2018). The molecular landscape of pediatric acute myeloid leukemia reveals
recurrent structural alterations and age-specific mutational interactions. Nat.
Med. 24 103–112. 10.1038/nm.4439 [PMC free article] [PubMed] [CrossRef]
[Google Scholar]
14. Booth C. A. G., Barkas N., Neo W. H., Boukarabila H., Soilleux E. J.,
Giotopoulos G., et al. (2018). Ezh2 and Runx1 mutations collaborate to initiate
Lympho-myeloid leukemia in early Thymic progenitors. Cancer Cell 33
274–291.e8. 10.1016/j.ccell.2018.01.006 [PubMed] [CrossRef] [Google Scholar]
15. Buekley J. D., Buckley C. M., Breslow N. E., Draper G. J., Roberson P. K.,
Mack T. M. (1996). Concordance for childhood cancer in twins. Med. Pediatr.
Oncol. 26 223–229. 10.1002/(sici)1096-911x(199604)26:4<223::aid-
mpo1>3.0.co;2-l [PubMed] [CrossRef] [Google Scholar]
16. Castor A., Nilsson L., Åstrand-Grundström I., Buitenhuis M., Ramirez C.,
Anderson K., et al. (2005). Distinct patterns of hematopoietic stem cell
involvement in acute lymphoblastic leukemia. Nat. Med. 11 630–637.
10.1038/nm1253 [PubMed] [CrossRef] [Google Scholar]
17. Chaudhury S., O’Connor C., Cañete A., Bittencourt-Silvestre J., Sarrou E.,
Prendergast Á., et al. (2018). Age-specific biological and molecular profiling
distinguishes paediatric from adult acute myeloid leukaemias. Nat. Commun.
9:5280. 10.1038/s41467-018-07584-1 [PMC free article] [PubMed] [CrossRef]
[Google Scholar]
18. Chen M. J., Li Y., De Obaldia M. E., Yang Q., Yzaguirre A. D., Yamada-Inagawa
T., et al. (2011). Erythroid/myeloid progenitors and hematopoietic stem cells
originate from distinct populations of endothelial cells. Cell Stem Cell 9
541–552. 10.1016/j.stem.2011.10.003 [PMC free article] [PubMed] [CrossRef]
[Google Scholar]
19. Chen W., Gerard O., Sullivan M., Hudson W., Kersey J. (2011). Modeling
human infant MLL leukemia in mice: leukemia from fetal liver differs from that
originating in postnatal marrow. Blood 117 3474–3475. 10.1182/blood-2010-11-
317529 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
20. Chen X., Burkhardt D. B., Hartman A. A., Hu X., Eastman A. E., Sun C., et al.
(2019). MLL-AF9 initiates transformation from fast-proliferating myeloid
progenitors. Nat. Commun. 10:5767. 10.1038/s41467-019-13666-5 [PMC free
article] [PubMed] [CrossRef] [Google Scholar]
21. Clarkson B. D., Boyse E. (1971). Possible explanation of the high concordance
for acute leukaemia in monozygotic twins. Lancet 1 699–701. 10.1016/s0140-
6736(71)92705-x [PubMed] [CrossRef] [Google Scholar]
22. de Bruijn M., Speck N. A., Peeters M. C. E., Dzierzak E. (2000). Definitive
hematopoietic stem cells first develop within the major arterial regions of the
mouse embryo. EMBO J. 19 2465–2474. 10.1093/emboj/19.11.2465 [PMC free
article] [PubMed] [CrossRef] [Google Scholar]
23. de Bruijn M. F. T. R., Ma X., Robin C., Ottersbach K., Sanchez M. J., Dzierzak
E. (2002). Hematopoietic stem cells localize to the endothelial cell layer in the
midgestation mouse aorta. Immunity 16 673–683. 10.1016/S1074-
7613(02)00313-8 [PubMed] [CrossRef] [Google Scholar]
24. Dege C., Fegan K. H., Creamer J. P., Berrien-Elliott M. M., Luff S. A., Kim D., et
al. (2020). Potently cytotoxic natural killer cells initially emerge from Erythro-
myeloid progenitors during mammalian development. Dev. Cell 53 229–239.e7.
10.1016/j.devcel.2020.02.016. [PMC free article] [PubMed] [CrossRef] [Google
Scholar]
25. Dzierzak E., Bigas A. (2018). Blood development: hematopoietic stem cell
dependence and independence. Cell Stem Cell 22 639–651.
10.1016/j.stem.2018.04.015 [PubMed] [CrossRef] [Google Scholar]
26. Easterbrook J., Rybtsov S., Gordon-Keylock S., Ivanovs A., Taoudi S.,
Anderson R. A., et al. (2019). Analysis of the spatiotemporal development of
hematopoietic stem and progenitor cells in the early human embryo. Stem Cell
Rep. 12 1056–1068. 10.1016/j.stemcr.2019.03.003 [PMC free article] [PubMed]
[CrossRef] [Google Scholar]
27. Enzan H. (1964). Electron microscopic studies of macrophages in early human
yolk sacs. Acta Pathol. Jpn. 36 49–64. 10.1002/bip.1964.360020311 [PubMed]
[CrossRef] [Google Scholar]
28. Epelman S., Lavine K. J., Beaudin A. E., Sojka D. K., Carrero J. A., Calderon
B., et al. (2014). Embryonic and adult-derived resident cardiac macrophages
are maintained through distinct mechanisms at steady state and during
inflammation. Immunity 40 91–104. 10.1016/j.immuni.2013.11.019 [PMC free
article] [PubMed] [CrossRef] [Google Scholar]
29. Ferkowicz M. J., Starr M., Xie X., Li W., Johnson S. A., Shelley W. C., et al.
(2003). CD41 expression defines the onset of primitive and definitive
hematopoiesis in the murine embryo. Development 130 4393–4403.
10.1242/dev.00632 [PubMed] [CrossRef] [Google Scholar]
30. Ford A. M., Bennett C. A., Price C. M., Bruin M. C. A., Van Wering E. R.,
Greaves M. (1998). Fetal origins of the TEL-AML1 fusion gene in identical twins
with leukemia. Proc. Natl. Acad. Sci. U.S.A. 95 4584–4588.
10.1073/pnas.95.8.4584 [PMC free article] [PubMed] [CrossRef] [Google
Scholar]
31. Ford A. M., Ridge S. A., Cabrera M. E., Mahmoud H., Steel C. M., Chan L. C.,
et al. (1993). In utero rearrangements in the trithorax-related oncogene in infant
leukaemias. Nature 363 358–360. 10.1038/363358a0 [PubMed] [CrossRef]
[Google Scholar]
32. Frame J. M., Fegan K. H., Conway S. J., McGrath K. E., Palis J. (2016).
Definitive hematopoiesis in the yolk sac emerges from Wnt-responsive
hemogenic endothelium independently of circulation and arterial identity. Stem
Cells 34 431–444. 10.1002/stem.2213 [PMC free article] [PubMed] [CrossRef]
[Google Scholar]
33. Gale K. B., Ford A. M., Repp R., Borkhardt A., Keller C., Eden O. B., et al.
(1997). Backtracking leukemia to birth: identification of clonotypic gene fusion
sequences in neonatal blood spots. Proc. Natl. Acad. Sci. U.S.A. 94
13950–13954. 10.1073/pnas.94.25.13950 [PMC free article] [PubMed]
[CrossRef] [Google Scholar]
34. Gatta G., Botta L., Rossi S., Aareleid T., Bielska-Lasota M., Clavel J., et al.
(2014). Childhood cancer survival in Europe 1999-2007: results of
EUROCARE-5-a population-based study. Lancet Oncol. 15 35–47.
10.1016/S1470-2045(13)70548-5 [PubMed] [CrossRef] [Google Scholar]
35. Ghosn E., Yoshimoto M., Nakauchi H., Weissman I. L., Herzenberg L. A.
(2019). Hematopoietic stem cell-independent hematopoiesis and the origins of
innate-like B lymphocytes. Development 146:dev170571. 10.1242/dev.170571
[PMC free article] [PubMed] [CrossRef] [Google Scholar]
36. Gomez Perdiguero E., Klapproth K., Schulz C., Busch K., Azzoni E., Crozet L.,
et al. (2015). Tissue-resident macrophages originate from yolk-sac-derived
erythro-myeloid progenitors. Nature 518 547–551. 10.1038/nature13989 [PMC
free article] [PubMed] [CrossRef] [Google Scholar]
37. Greaves M. (1999). Molecular genetics, natural history and the demise of
childhood leukaemia. Eur. J. Cancer 35 1941–1953. 10.1016/S0959-
8049(99)00296-8 [PubMed] [CrossRef] [Google Scholar]
38. Greaves M. (2005). In utero origins of childhood leukaemia. Early Hum. Dev. 81
123–129. 10.1016/j.earlhumdev.2004.10.004 [PubMed] [CrossRef] [Google
Scholar]
39. Greaves M. F., Maia A. T., Wiemels J. L., Ford A. M. (2003). Leukemia in twins :
lessons in natural history. Blood 102 2321–2333. 10.1182/blood-2002-12-3817
[PubMed] [CrossRef] [Google Scholar]
40. Gröbner S. N., Worst B. C., Weischenfeldt J., Buchhalter I., Kleinheinz K.,
Rudneva V. A., et al. (2018). The landscape of genomic alterations across
childhood cancers. Nature 555 321–327. 10.1038/nature25480 [PubMed]
[CrossRef] [Google Scholar]
41. Harrison C. J., Hills R. K., Moorman A. V., Grimwade D. J., Hann I., Webb D. K.
H., et al. (2010). Cytogenetics of childhood acute myeloid leukemia: United
Kingdom Medical Research Council Treatment Trials AML 10 and 12. J. Clin.
Oncol. 28 2674–2681. 10.1200/JCO.2009.24.8997 [PubMed] [CrossRef]
[Google Scholar]
42. Hein D., Borkhardt A., Fischer U. (2020). Insights into the prenatal origin of
childhood acute lymphoblastic leukemia. Cancer Metastasis Rev. 39 161–171.
10.1007/s10555-019-09841-1 [PMC free article] [PubMed] [CrossRef] [Google
Scholar]
43. Hilden J. M., Dinndorf P. A., Meerbaum S. O., Sather H., Villaluna D., Heerema
N. A., et al. (2006). Analysis of prognostic factors of acute lymphoblastic
leukemia in infants: report on CCG 1953 from the Children’s Oncology Group.
Blood 108 441–451. 10.1182/blood-2005-07-3011 [PMC free article] [PubMed]
[CrossRef] [Google Scholar]
44. Horton S. J., Jaques J., Woolthuis C., Van Dijk J., Mesuraca M., Huls G., et al.
(2013). MLL-AF9-mediated immortalization of human hematopoietic cells along
different lineages changes during ontogeny. Leukemia 27 1116–1126.
10.1038/leu.2012.343 [PubMed] [CrossRef] [Google Scholar]
45. Howlader N., Noone A., Krapcho M., Miller D., Brest A., Yu M., et al. (2020).
SEER Cancer Statistics Review, 1975-2017. Bethesda, MD: National Cancer
Institute. [Google Scholar]
46. Ivanovs A., Rybtsov S., Welch L., Anderson R. A., Turner M. L., Medvinsky A.
(2011). Highly potent human hematopoietic stem cells first emerge in the
intraembryonic aorta-gonad-mesonephros region. J. Exp. Med. 208 2417–2427.
10.1084/jem.20111688 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
47. Julien E., El Omar R., Tavian M. (2016). Origin of the hematopoietic system in
the human embryo. FEBS Lett. 590 3987–4001. 10.1002/1873-3468.12389
[PubMed] [CrossRef] [Google Scholar]
48. Kim I., He S., Yilmaz H., Kiel M. J., Morrison S. J. (2006). Enhanced purification
of fetal liver hematopoietic stem cells using SLAM family receptors. Blood 108
737–744. 10.1182/blood-2005-10-4135 [PMC free article] [PubMed] [CrossRef]
[Google Scholar]
49. Kissa K., Herbomel P. (2010). Blood stem cells emerge from aortic endothelium
by a novel type of cell transition. Nature 464 112–115. 10.1038/nature08761
[PubMed] [CrossRef] [Google Scholar]
50. Kong Y., Yoshida S., Saito Y., Doi T., Nagatoshi Y., Fukata M., et al. (2008).
CD34+CD38+CD19+ as well as CD34+CD38-CD19+ cells are leukemia-
initiating cells with self-renewal capacity in human B-precursor ALL. Leukemia
22 1207–1213. 10.1038/leu.2008.83 [PubMed] [CrossRef] [Google Scholar]
51. Kumaravelu P., Hook L., Morrison A. M., Ure J., Zhao S., Zuyev S., et al.
(2002). Quantitative developmental anatomy of definitive haematopoietic stem
cells/long-term repopulating units (HSC/RUs): role of the aorta-gonad-
mesonephros (AGM) region and the yolk sac in colonisation of the mouse
embryonic liver. Development 129 4891–4899. [PubMed] [Google Scholar]
52. le Viseur C., Hotfilder M., Bomken S., Wilson K., Röttgers S., Schrauder A., et
al. (2008). In childhood acute lymphoblastic leukemia, blasts at different stages
of immunophenotypic maturation have stem cell properties. Cancer Cell 14
47–58. 10.1016/j.ccr.2008.05.015.In [PMC free article] [PubMed] [CrossRef]
[Google Scholar]
53. Li Z., Lan Y., He W., Chen D., Wang J., Zhou F., et al. (2012). Mouse embryonic
head as a site for hematopoietic stem cell development. Cell Stem Cell 11
663–675. 10.1016/j.stem.2012.07.004 [PubMed] [CrossRef] [Google Scholar]
54. Lin S., Luo R. T., Ptasinska A., Kerry J., Assi S. A., Wunderlich M., et al. (2016).
Instructive role of MLL-fusion proteins revealed by a model of t(4;11) Pro-B
Acute Lymphoblastic Leukemia. Cancer Cell 30 737–749.
10.1016/j.ccell.2016.10.008 [PubMed] [CrossRef] [Google Scholar]
55. Liu Y. F., Wang B. Y., Zhang W. N., Huang J. Y., Li B. S., Zhang M., et al.
(2016). Genomic profiling of adult and pediatric B-cell acute lymphoblastic
leukemia. EBioMedicine 8 173–183. 10.1016/j.ebiom.2016.04.038 [PMC free
article] [PubMed] [CrossRef] [Google Scholar]
56. Locatelli F., Crotta A., Ruggeri A., Eapen M., Wagner J. E., MacMillan M. L., et
al. (2013). Analysis of risk factors influencing outcomes after cord blood
transplantation in children with juvenile myelomonocytic leukemia: a
EUROCORD, EBMT, EWOG-MDS,CIBMTR study. Blood 122 2135–2141.
10.1182/blood-2013-03-491589 [PMC free article] [PubMed] [CrossRef] [Google
Scholar]
57. Lopez C. K., Noguera E., Stavropoulou V., Robert E., Aid Z., Ballerini P., et al.
(2019). Ontogenic changes in hematopoietic hierarchy determine pediatric
specificity and disease phenotype in fusion oncogene– driven myeloid
leukemia. Cancer Discov. 9 1736–1753. 10.1158/2159-8290.CD-18-1463
[PubMed] [CrossRef] [Google Scholar]
58. MacMahon B., Levy M. A. (1964). Prenatal origin of childhood leukemia. N.
Engl. J. Med. 270 1082–1085. 10.1056/NEJM196405212702102 [PubMed]
[CrossRef] [Google Scholar]
59. Maia A. T., Koechling J., Corbett R., Metzler M., Wiemels J. L., Greaves M.
(2004). Protracted postnatal natural histories in childhood leukemia. Genes
Chromosom. Cancer 39 335–340. 10.1002/gcc.20003 [PubMed] [CrossRef]
[Google Scholar]
60. Malard F., Mohty M. (2020). Acute lymphoblastic leukaemia. Lancet 395
1146–1162. 10.1016/S0140-6736(19)33018-1 [PubMed] [CrossRef] [Google
Scholar]
61. Man N., Sun X. J., Tan Y., García-Cao M., Liu F., Cheng G., et al. (2016).
Differential role of Id1 in MLL-AF9-driven leukemia based on cell of origin.
Blood 127 2322–2326. 10.1182/blood-2015-11-677708 [PMC free article]
[PubMed] [CrossRef] [Google Scholar]
62. Masetti R., Vendemini F., Zama D., Biagi C., Pession A., Locatelli F. (2015).
Acute myeloid leukemia in infants: biology and treatment. Front. Pediatr. 3:37.
10.3389/fped.2015.00037 [PMC free article] [PubMed] [CrossRef] [Google
Scholar]
63. Mass E., Ballesteros I., Farlik M., Halbritter F., Günther P., Crozet L., et al.
(2016). Specification of tissue-resident macrophages during organogenesis.
Science 353:aaf4238. 10.1126/science.aaf4238 [PMC free article] [PubMed]
[CrossRef] [Google Scholar]
64. Mass E., Jacome-Galarza C. E., Blank T., Lazarov T., Durham B. H., Ozkaya
N., et al. (2017). A somatic mutation in erythro-myeloid progenitors causes
neurodegenerative disease. Nature 549 389–393. 10.1038/nature23672 [PMC
free article] [PubMed] [CrossRef] [Google Scholar]
65. Matsuda K., Sakashita K., Taira C., Tanaka-Yanagisawa M., Yanagisawa R.,
Shiohara M., et al. (2010). Quantitative assessment of PTPN11 or RAS
mutations at the neonatal period and during the clinical course in patients with
juvenile myelomonocytic leukaemia. Br. J. Haematol. 148 593–599.
10.1111/j.1365-2141.2009.07968.x [PubMed] [CrossRef] [Google Scholar]
66. McGrath K. E., Frame J. M., Fegan K. H., Bowen J. R., Conway S. J.,
Catherman S. C., et al. (2015a). Distinct sources of hematopoietic progenitors
emerge before HSCs and provide functional blood cells in the mammalian
embryo. Cell Rep. 11 1892–1904. 10.1016/j.celrep.2015.05.036 [PMC free
article] [PubMed] [CrossRef] [Google Scholar]
67. McGrath K. E., Frame J. M., Palis J. (2015b). Early hematopoiesis and
macrophage development. Semin. Immunol. 27 379–387.
10.1016/j.smim.2016.03.013 [PMC free article] [PubMed] [CrossRef] [Google
Scholar]
68. Medvinsky A., Dzierzak E. (1996). Definitive hematopoiesis is autonomously
initiated by the AGM region. Cell 86 897–906. 10.1016/S0092-8674(00)80165-8
[PubMed] [CrossRef] [Google Scholar]
69. Menendez P., Catalina P., Rodríguez R., Melen G. J., Bueno C., Arriero M., et
al. (2009). Bone marrow mesenchymal stem cells from infants with MLL-AF4+
acute leukemia harbor and express the MLL-AF4 fusion gene. J. Exp. Med. 206
3131–3141. 10.1084/jem.20091050 [PMC free article] [PubMed] [CrossRef]
[Google Scholar]
70. Meyer C., Burmeister T., Gröger D., Tsaur G., Fechina L., Renneville A., et al.
(2018). The MLL recombinome of acute leukemias in 2017. Leukemia 32
273–284. 10.1038/leu.2017.213 [PMC free article] [PubMed] [CrossRef]
[Google Scholar]
71. Müller A. M., Medvinsky A., Strouboulis J., Grosveld F., Dzierzakt E. (1994).
Development of hematopoietic stem cell activity in the mouse embryo. Immunity
1 291–301. 10.1016/1074-7613(94)90081-7 [PubMed] [CrossRef] [Google
Scholar]
72. Ottersbach K. (2019). Endothelial-to-haematopoietic transition: an update on
the process of making blood. Biochem. Soc. Trans. 47 591–601.
10.1042/BST20180320 [PMC free article] [PubMed] [CrossRef] [Google
Scholar]
73. Ottersbach K., Dzierzak E. (2005). The murine placenta contains hematopoietic
stem cells within the vascular labyrinth region. Dev. Cell 8 377–387.
10.1016/j.devcel.2005.02.001 [PubMed] [CrossRef] [Google Scholar]
74. Palis J. (2016). Hematopoietic stem cell-independent hematopoiesis:
emergence of erythroid, megakaryocyte, and myeloid potential in the
mammalian embryo. FEBS Lett. 590 3965–3974. 10.1002/1873-3468.12459
[PubMed] [CrossRef] [Google Scholar]
75. Palis J., Chan R. J., Koniski A., Patel R., Starr M., Yoder M. C. (2001). Spatial
and temporal emergence of high proliferative potential hematopoietic
precursors during murine embryogenesis. Proc. Natl. Acad. Sci. U.S.A. 98
4528–4533. 10.1073/pnas.071002398 [PMC free article] [PubMed] [CrossRef]
[Google Scholar]
76. Palis J., Robertson S., Kennedy M., Wall C., Keller G. (1999). Development of
erythroid and myeloid progenitors in the yolk sac and embryo proper of the
mouse. Development 126 5073–5084. [PubMed] [Google Scholar]
77. Papaemmanuil E., Gerstung M., Bullinger L., Gaidzik V. I., Paschka P., Roberts
N. D., et al. (2016). Genomic classification and prognosis in acute myeloid
leukemia. N. Engl. J. Med. 374 2209–2221. 10.1056/NEJMoa1516192 [PMC
free article] [PubMed] [CrossRef] [Google Scholar]
78. Pieters R., Schrappe M., De Lorenzo P., Hann I., De Rossi G., Felice M., et al.
(2007). A treatment protocol for infants younger than 1 year with acute
lymphoblastic leukaemia (Interfant-99): an observational study and a
multicentre randomised trial. Lancet 370 240–250. 10.1016/S0140-
6736(07)61126-X [PubMed] [CrossRef] [Google Scholar]
79. Rice S., Roy A. (2020). MLL-rearranged infant leukaemia : a ‘ thorn in the side ’
of a remarkable success story. Biochim. Biophys. Acta Gene Regul. Mech.
1863:194564. 10.1016/j.bbagrm.2020.194564 [PubMed] [CrossRef] [Google
Scholar]
80. Robin C., Bollerot K., Mendes S., Haak E., Crisan M., Cerisoli F., et al. (2010).
Human placenta is a potent hematopoietic niche containing hematopoietic stem
and progenitor cells throughout development. Cell Stem Cell 5 385–395.
10.1016/j.stem.2009.08.020 [PMC free article] [PubMed] [CrossRef] [Google
Scholar]
81. Rowe R. G., Da Rocha E. L., Sousa P., Missios P., Morse M., Marion W., et al.
(2019). The developmental stage of the hematopoietic niche regulates lineage
in MLL-rearranged leukemia. J. Exp. Med. 216 527–538.
10.1084/jem.20181765 [PMC free article] [PubMed] [CrossRef] [Google
Scholar]
82. Rybtsov S., Batsivari A., Bilotkach K., Paruzina D., Senserrich J., Nerushev O.,
et al. (2014). Tracing the origin of the HSC hierarchy reveals an SCF-
dependent, IL-3-independent CD43- embryonic precursor. Stem Cell Rep. 3
489–501. 10.1016/j.stemcr.2014.07.009 [PMC free article] [PubMed] [CrossRef]
[Google Scholar]
83. Rybtsov S., Ivanovs A., Zhao S., Medvinsky A. (2016). Concealed expansion of
immature precursors underpins acute burst of adult HSC activity in foetal liver.
Development 143 1284–1289. 10.1242/dev.131193 [PMC free article] [PubMed]
[CrossRef] [Google Scholar]
84. Rybtsov S., Sobiesiak M., Taoudi S., Souilhol C., Senserrich J., Liakhovitskaia
A., et al. (2011). Hierarchical organization and early hematopoietic specification
of the developing HSC lineage in the AGM region. J. Exp. Med. 208
1305–1315. 10.1084/jem.20102419 [PMC free article] [PubMed] [CrossRef]
[Google Scholar]
85. Schulz C., Perdiguero E. G., Chorro L., Szabo-Rogers H., Cagnard N., Kierdorf
K., et al. (2012). A lineage of myeloid cells independent of myb and
hematopoietic stem cells. Science 335 86–90. 10.1126/science.1219179
[PubMed] [CrossRef] [Google Scholar]
86. Shalapour S., Eckert C., Seeger K., Pfau M., Prada J., Henze G., et al. (2010).
Leukemia-associated genetic aberrations in mesenchymal stem cells of children
with acute lymphoblastic leukemia. J. Mol. Med. 88 249–265. 10.1007/s00109-
009-0583-8 [PubMed] [CrossRef] [Google Scholar]
87. Sinha R., Porcheri C., d’Altri T., González J., Ruiz-Herguido C., Rabbitts T., et
al. (2020). Development of embryonic and adult leukemia mouse models driven
by MLL-ENL translocation. Exp. Hematol. 85 13–19.
10.1016/j.exphem.2020.04.008 [PubMed] [CrossRef] [Google Scholar]
88. Steliarova-Foucher E., Colombet M., Ries L. A. G., Moreno F., Dolya A., Bray
F., et al. (2017). International incidence of childhood cancer, 2001–10: a
population-based registry study. Lancet Oncol. 18 719–731. 10.1016/S1470-
2045(17)30186-9 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
89. Swiers G., Rode C., Azzoni E., de Bruijn M. F. T. R. (2016). A short history of
hemogenic endothelium. Blood Cells Mol. Dis. 51 206–212.
10.1016/j.bcmd.2013.09.005 [PMC free article] [PubMed] [CrossRef] [Google
Scholar]
90. Taoudi S., Gonneau C., Moore K., Sheridan J. M., Blackburn C. C., Taylor E., et
al. (2008). Extensive hematopoietic stem cell generation in the AGM region via
maturation of VE-Cadherin+CD45+ pre-definitive HSCs. Cell Stem Cell 3
99–108. 10.1016/j.stem.2008.06.004 [PubMed] [CrossRef] [Google Scholar]
91. Tarnawsky S. P., Yoshimoto M., Deng L., Chan R. J., Yoder M. C. (2017). Yolk
sac erythromyeloid progenitors expressing gain of function PTPN11 have
functional features of JMML but are not sufficient to cause disease in mice. Dev.
Dyn. 246 1001–1014. 10.1002/dvdy.24598 [PMC free article] [PubMed]
[CrossRef] [Google Scholar]
92. Tavian M., Robin C., Coulombel L., Péault B. (2001). The human embryo, but
not its yolk sac, generates lympho-myeloid stem cells: mapping multipotent
hematopoietic cell fate in intraembryonic mesoderm. Immunity 15 487–495.
10.1016/S1074-7613(01)00193-5 [PubMed] [CrossRef] [Google Scholar]
93. Tober J., Koniski A., McGrath K. E., Vemishetti R., Emerson R., De Mesy-
Bentley K. K. L., et al. (2007). The megakaryocyte lineage originates from
hemangioblast precursors and is an integral component both of primitive and of
definitive hematopoiesis. Blood 109 1433–1441. 10.1182/blood-2006-06-
031898 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
94. Uckun F., Herman-Hatten K., Crotty M., Sensel M., Sather H., Tuel-Ahlgren L.,
et al. (1998). Clinical significance of MLL-AF4 fusion transcript expression in the
absence of a cytogenetically detectable t(4;11)(q21;q23) chromosomal
translocation. Blood 810–821. [PubMed] [Google Scholar]
95. Wiemels J. L., Cazzaniga G., Daniotti M., Eden O. B., Addison G. M., Masera
G., et al. (1999). Prenatal origin of acute lymphoblastic leukaemia in children.
Lancet 354 1499–1503. 10.1016/S0140-6736(99)094039 [PubMed] [CrossRef]
[Google Scholar]
96. Wiemels J. L., Xiao Z., Buffler P. A., Maia A. T., Ma X., Dicks B. M., et al.
(2002). In utero origin of t(8;21) AML1-ETO translocations in childhood acute
myeloid leukemia. Blood 99 3801–3805. 10.1182/blood.V99.10.3801 [PubMed]
[CrossRef] [Google Scholar]
97. Xu M. J., Matsuoka S., Yang F. C., Ebihara Y., Manabe A., Tanaka R., et al.
(2001). Evidence for the presence of murine primitive megakarycytopoiesis in
the early yolk sac. Blood 97 2016–2022. 10.1182/blood.V97.7.2016 [PubMed]
[CrossRef] [Google Scholar]
98. Zhou F., Li X., Wang W., Zhu P., Zhou J., He W., et al. (2016). Tracing
haematopoietic stem cell formation at single-cell resolution. Nature 533
487–492. 10.1038/nature17997 [PubMed] [CrossRef] [Google Scholar]

Medicina de Precisión para mi tipo de Cáncer

Testimonio de Cáncer:

La interacción de la inflamación y el cáncer: una revisión de las publicaciones

El estado actual de la investigación para el uso Paliativo y Transquimioterapia de altas dosis de vitamina C en el cáncer

Cáncer de mama durante el Embarazo:Resultados neonatales (los bebes) después de la quimioterapia

CÁNCER DE MAMA DURANTE EL EMBARAZO: RESULTADOS NEONATALES (LOS BEBÉS) DESPUÉS DE LA QUIMIOTERAPIA
- 7 Avenida 12-23 Zona 9, Edificio Etisa, 5o. Nivel Ala Norte, Oficina 5.6 Guatemala.
